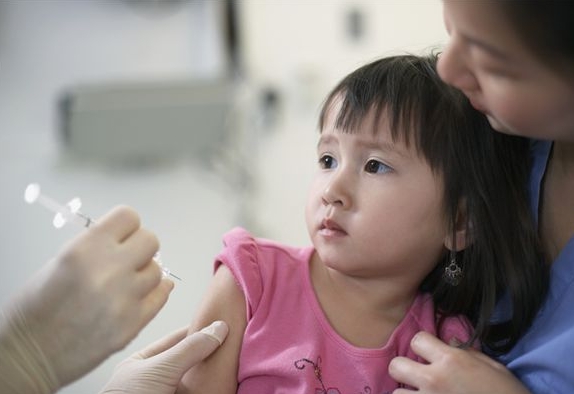
1963年,卫生部、化工部、商业部联合制定《关于药政管理的若干规定》,对新药报批程序、新药生产审批等作出了规定。
1978年,国务院批准发布《药政管理条例》。
1979年,卫生部制定《新药管理办法》,规定除创新的重大品种及国内未生产过的放射性药品、麻醉药品、中药人工合成品、避孕药品由卫生部审批外,其他新药均由省级卫生行政部门审批。
1984年9月,全国人大常委会颁布《药品管理法》,这部法律被看做是中国药品管理制度的雏形,规定了药品的市场准入机制,开办药品生产企业、经营企业,必须经所在省级主管部门审查同意,并发给许可证。
1985年,卫生部制定颁布《新药审批办法》,规定新药由卫生部集中统一审批,各省级卫生行政部门为初审单位。同时对新药申请生产之前须呈报的临床试验、各类新药安全性和有效性评价及有关技术要求等均作出了具体规定。
1998年8月,国家药品监督管理局(SDA)成立。
1999年5月,SDA颁布《新药审批办法》,明确新药的定义是“我国未生产过的药品”,首次提出加快审评的程序规定。
2001年,《药品管理法》完成第一次修订。修订后的《药品管理法》改变了新药审批在国家一级,而仿制药及保健药品的审批在省一级的规定,药品审评审批权全部上归国务院药品监督管理部门,各省级药品监督管理部门对药品的初审是国家药品一级审评中的一部分。
2002年8月,国务院颁布《药品管理法实施条例》,将新药的概念修改为“未曾在中国境内上市销售的药品”。
2003年,国家食品药品监督管理局成立。
2005年修订后的《药品注册管理办法》规定,已上市药品改变剂型、改变给药途径、增加新适应证,仍按新药申请管理。并确立了新的药品注册审批模式:省级监管部门首先进行形式审查和现场核查,重点审查其规范性和真实性;省级监管部门将审查结论和全部申报资料上报国家食品药品监督管理局,国家局组织进行技术审评,最后作出是否批准的决定。
2007年,《药品注册管理办法》再次修订,明确已上市药品改变剂型、改变给药途径或增加适应证,注册时只能按程序申报,而不再按照新药管理;将新药中的“已有国家标准的药品”改为“仿制药”。
2013年,国家食品药品监督管理总局成立。
2015年8月,国务院发布《关于改革药品医疗器械审评审批制度的意见》。
创新药审评归入“无灯区” 上一篇 | 下一篇 药品审批能否提档加速
- 基层全科医生实践技能有了“标尺”2013-03-15
- 武汉启动人体器官捐献工作 捐献者须自愿无偿2010-07-21
- 国家药监局推行药品“电子身份证”监管制度2009-06-23
- 国家计生委:非法鉴定胎儿性别最高可追刑责2011-08-17
- 中红十字会推出救助贫困矮小患儿医疗项目2010-04-26
- 工商总局:5类食品须退市销毁 记录至少保存3年2011-08-17
- 卫生部要求二级以上医院须配临床药师2011-04-01
- 非医学需要的B超鉴定胎儿性别将被依法重罚 2011-08-17
- 卫生部调整中外合资合作医疗机构审批权限2011-02-16
- 江西:贫困家庭儿童患大病可获医疗救助2010-05-27
-
医生姓名:刘伏友
所在科室:肾内科
工作医院:中南大学湘雅二医院
专业职称:主任医师
擅长疾病: 腹膜透析、各类肾病、慢性肾功能衰竭、尿毒症、血液...